Législation
|
MAJ le 22/03/2024
"Pour assurer leur identification et leur traçabilité, les produits d'optique lunetterie correctrice et d'appareillage des déficients de l'ouïe doivent être accompagnés depuis leur fabrication jusqu'à la délivrance au consommateur final des informations suivantes : - le nom et l'adresse du fabricant, ainsi que le nom et l'adresse de son mandataire si le fabricant n'a pas de siège social dans l'Union Européenne ; - pour les dispositifs réalisés selon les spécifications du prescripteur, le numéro d'identification des dispositifs constituant l'équipement ; - pour les dispositifs fabriqués en série de manière identique, le numéro du lot ou le numéro de série et, s'il existe, l'identifiant unique du dispositif ou tout autre code d'identification attribué par son fabricant. Ces informations figurent sur tout dispositif ou à défaut sur son emballage ou sur les documents accompagnant sa délivrance et remis au consommateur."
En plus, si vous fabriquez des montures de série ou considérées comme adaptables: (la plupart des cas)
Si vous réalisez des montures sur-mesure
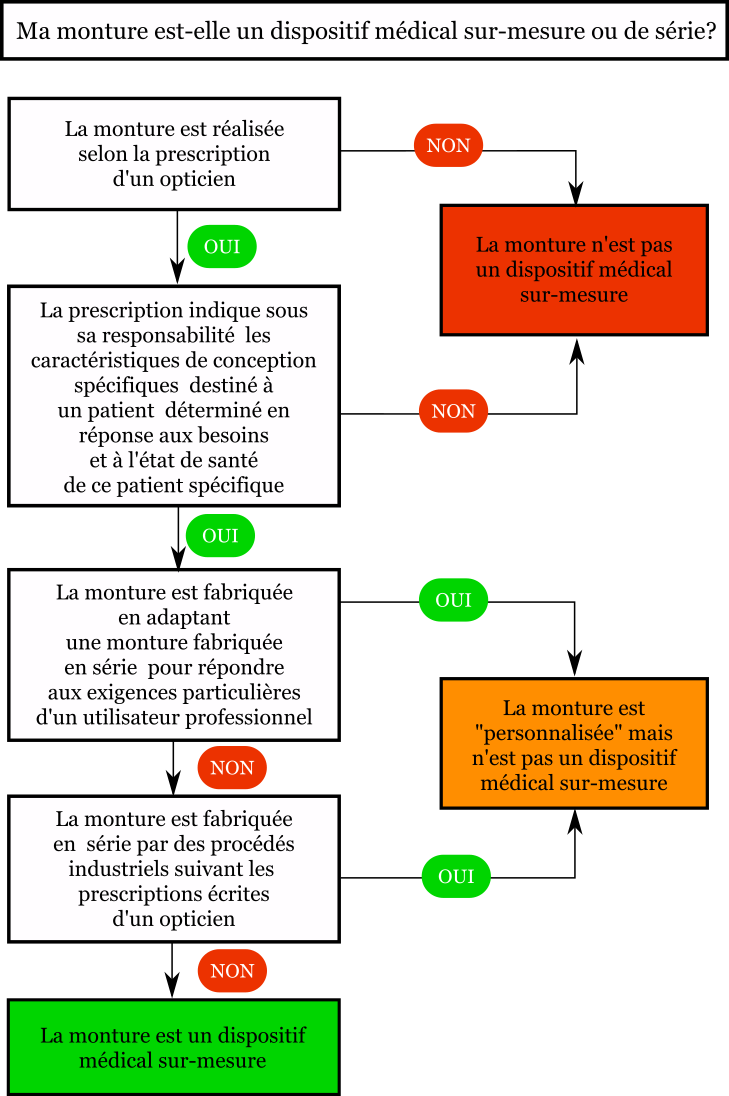
Définition UE d'un dispositif médical sur-mesure: «dispositif sur mesure», tout dispositif fabriqué expressément suivant la prescription écrite de toute personne habilitée par la législation nationale en vertu de ses qualifications professionnelles, indiquant, sous sa responsabilité, les caractéristiques de conception spécifiques, et destiné à n'être utilisé que pour un patient déterminé et exclusivement en réponse aux besoins et à l'état de santé de ce patient. En revanche, ne sont pas considérés comme des dispositifs sur mesure les dispositifs fabriqués en série qui nécessitent une adaptation pour répondre aux exigences particulières de tout utilisateur professionnel, ni les dispositifs qui sont produits en série par des procédés de fabrication industriels suivant les prescriptions écrites de toute personne habilitée;
Document d'aide à la définition d'un dispositif médical sur mesure (FAQ):
Résumé succin:
Vous vendez hors UE
Vous devez vous enregistrer à la FDA (enregistrement payant chaque année), et avoir sur place une personne ou entreprise de confiance qui gère les demandes de la FDA. Redevance minimale FDA 5000$/an. Prenez contact avec GS1 pour les informations détaillées.
Vous devez vous enregistrer et obtenir un numéro Swissmedic pour toutes les pièces de montures que vous faites entrer sur le territoire (solaires comprises). Il vous faudra également une personne / entreprise de confiance sur place. Redevance environ 20 000 CHF/ an. Chaque monture doit avoir son numéro IUD/UDI. https://www.swissmedic.ch/swissmedic/fr/home.html
Toutes ces mesures, bien que très contraignantes, ont été créées pour tracer l'ensemble des dispositifs médicaux afin de pouvoir facilement remonter la chaine de production en cas de problème majeur ou mineur (souvenons nous des prothèses PIP et les plus de 30 000 femmes mises en danger de mort à cause d'une absence totale de traçabilité...)
Les lunettes de soleil en UE ne sont pas considérées comme des dispositifs médicaux mais comme des équipements de protection individuelle, soumises aux normes ISO 12312-1:2013 et ISO 12311-2013 Pour chaque modèle, il faudra, une fois les tests effectués, établir un dossier technique et un certificat UE attestant de la conformité aux normes. Attention! Si vous fabriquez des lunettes de soleil qui sont prévues pour être équipées de verres solaires correcteurs ("Rx-ables"), les deux règlementations s'appliquent simultanément.
Liens importants: |
||||||||||
|
Acheter le dossier de norme ISO 12870:2016 (dite "norme CE" ): |
Attention, cette norme est bientôt caduque, remplacée par ISO/CD 12870 en cours d'élaboration |
|||||||||
| Test/ Normes CE : |
La norme CE est obligatoire pour les montures de lunettes en prêt à porter. Le sur-mesure n'est pas (encore...) concerné. |
|||||||||
| S'enregistrer comme fabricant de dispositifs médicaux (niveau européen) |
|
|||||||||
| S'enregistrer comme fabricant de dispositifs médicaux de classe I (niveau France) |
Base de données Eudamed: informations contact: Il est obligatoire pour toute entité fabriquant des dispositifs médicaux de s'enregistrer comme fabricant auprès de l'ANSM Comment s'enregistrer?
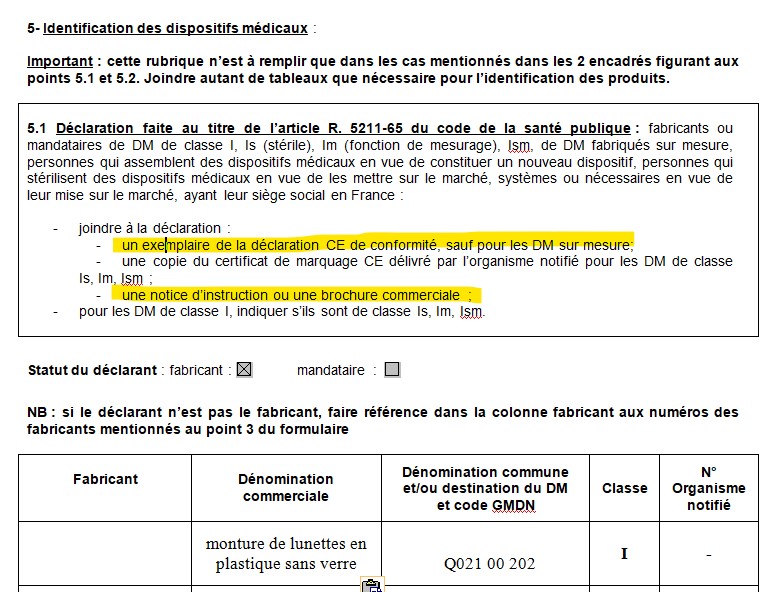
Les dispositions d’enregistrement des acteurs en l’absence d’Eudamed « pleinement opérationnelle » sont disponibles ici. Petite aide pour remplir la partie 5.1 si vous ne faites que du sur-mesure: Dénomination commerciale: "montures de lunettes" Dénomination commune et code GMDN: Dispositif ophtalmologique reposant sur le nez et les oreilles de l’utilisateur et dans lequel reposent des verres de lunettes protecteurs ou correcteurs. 32816 Attention, nouveauté de déclaration 2023: Dénomination commerciale "monture de lunettes en plastique sans verre" Code EMDM=Q021 00 202 Classe I N° organisme notifié: numéro de l'organisme chargé de réaliser les audits qualité - non obligatoire dans le cas des montures de lunettes (DM classe 1). Et on est heureux que ce ne soit pas obligatoire car ça coûte très cher! ou par envoi recommandé avec demande d’avis de réception à : |
|||||||||
| Démarche pour obtenir les codes individuels fabricant: |
Marche à suivre: - Vous connecter - "Commencer un nouveau dossier" - Remplir les données personnelles et professionnelles - Dans "code Lpp concerné par la déclaration", choisir "Titre II" dans le menu déroulant - Dans "valeur secondaire", choisir le code voulu (1 seul pour chaque demande)
- Dans "code Lpp concerné", mettre N/A - "Première déclaration de référence": "oui" si c'est votre première demande de code Lpp - "Code individuel fabricant" à remplir seulement si vous avez déjà reçu un premier code - "Références commercialisées": y noter votre marque, ou vos marques les unes en dessous des autres - Engagement de conformité: La norme CE est obligatoire pour le prêt à porter et les montures dites personnalisées ou adaptables. Le sur-mesure n'est pas encore concerné, cocher "oui". - Déposez le dossier et attendez plusieurs mois le retour par mail. - Faire une demande pour chaque code souhaité (adulte A, adulte B, enfant A, enfant B) |
|||||||||
| "Guide de survie" des fabricants de dispositifs médicaux: | ||||||||||
| Veille règlementaire |
La nouvelle règlementation européenne sur les dispositifs médicaux oblige à une veille règlementaire par une personne de niveau bac+4 ayant 2 ans d'expérience minimum dans ce domaine. Pour les PME il n'est pas nécessaire de bénéficier de cette expertise en interne, en revanche il faut en disposer en externe. L'adhésion au syndicat et ou à Gs1 doit pouvoir y aider. Exemple d'organismes permettant une veille règlementaire
|
|||||||||
| Obtention des codes IUD / UDI |
Adhérer à GS1 pour avoir accès à "codes online" et obtenir le code pour chaque modèle. |
|||||||||
| Déclaration des prix de vente CEPS | ||||||||||
| Aide concernant la déclaration des prix de vente CEPS |  et et Armez vous de courage et enfermez-vous au calme avant d'entreprendre cette démarche la première fois... |
|||||||||
| Articles concernant la revente de DM d'occasion |
Obligation de maintenance et de contrôle de qualité
Revente des dispositifs médicaux d'occasion (Articles R5212-35-1 à R5212-35-6) |
|||||||||
| AIDE/ FORMATION |
|
|||||||||